皆さんこんにちは。AmedTech代表の天野です。
つい先日Appleが新たなApple Watch Series 4をリリースしました。画面が大きくなったばかりではなく速度も速くなり、一層魅力的な時計になっていますが、同時にウェアラブルデバイスとしても大きく進歩しています。現在でも多くの会社が活動量計として時計に心拍数計や万歩計を組み込んだ製品を販売していますが、今回のApple Watch Series 4では心電図が測定できる機能を搭載しています。これはワクワクさせる機能ですよね。私もすぐにでも購入しようかと思ったのですが、実はこの機能は日本で販売する製品からは削除されています。正確に言えばハードウェアとしての機能は搭載しているがソフトウェアとして機能制限をかけている、ということです。そこで今回はApple Watch Series 4を中心にウェアラブルデバイスと医療機器についてお伝えしたいと思います。
Apple Watch Series 4 とECG
Apple のアメリカのサイトでは大きく取り上げられている心電図(ECG)の測定機能ですが、日本のWebサイトでは削除されています。これは、心電計は医療機器とみなされるため、日本では「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(医薬品医療機器等法)の規制に従う必要があり、現時点ではまだ認可が下りていないためです。こう言ってしまえば簡単ですが、ではどの部分が法の規制を受けるのでしょうか?
従来の医療機器は装置そのものがその装置を動かすための機能を内包していたため、装置単体が規制の対象でした。しかしながら、マイクロチップの進歩により、測定装置とそのデータを受けて解析する装置が分離するようになり、さらには解析自体がそれ専用の装置ではなく、一般のPCにソフトウェアを搭載することにより可能となってきたことから、Software as a Medical Device (SaMD)という考え方が芽生えてきました。International Medical Device Regulators Forum (IMDRF)では、2013からその定義について協議が開始されています。これらの活動を受けて、日本においても平成26年に改正された「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(医薬品医療機器等法)において、新たに医療機器プログラムとして定義がされました。以下にその一部を引用します。
第二条この法律で「医薬品」とは、次に掲げる物をいう。
一日本薬局方に収められている物
二人又は動物の疾病の診断、治療又は予防に使用されることが目的とされている物であつて、機械器具等(機械器具、歯科材
料、医療用品、衛生用品並びにプログラム(電子計算機に対する指令であつて、一の結果を得ることができるように組み合わ
されたものをいう。以下同じ。)及びこれを記録した記録媒体をいう。以下同じ。)でないもの(医薬部外品及び再生医療等
製品を除く。)
三人又は動物の身体の構造又は機能に影響を及ぼすことが目的とされている物であつて、機械器具等でないもの(医薬部外品
、化粧品及び再生医療等製品を除く。)
2-3 (略)
4この法律で「医療機器」とは、人若しくは動物の疾病の診断、治療若しくは予防に使用されること、又は人若しくは動物の身
体の構造若しくは機能に影響を及ぼすことが目的とされている機械器具等(再生医療等製品を除く。)であつて、政令で定める
ものをいう。
5-17 (略)
18 この法律にいう「物」には、プログラムを含むものとする。
法としてはこれだけですが、もっと具体的な記載が政令にあります。医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行令(昭和三十六年政令第十一号)の別表第一には以下の記述があります。
プログラム
一 疾病診断用プログラム(副作用又は機能の障害が生じた場合においても、人の生命及び健康に影響を与えるおそれがほとんどないものを除く。次項第一号において同じ。)
二 疾病治療用プログラム(副作用又は機能の障害が生じた場合においても、人の生命及び健康に影響を与えるおそれがほとんどないものを除く。次項第二号において同じ。)
三 疾病予防用プログラム(副作用又は機能の障害が生じた場合においても、人の生命及び健康に影響を与えるおそれがほとんどないものを除く。次項第三号において同じ。)
プログラムを記録した記録媒体
一 疾病診断用プログラムを記録した記録媒体
二 疾病治療用プログラムを記録した記録媒体
三 疾病予防用プログラムを記録した記録媒体
さらにプログラムの医療機器への該当性に関する基本的な考え方については平成26年11月14日付薬食監麻発1114第5号に以下の記載があります。
(1) 医薬品医療機器等法において医療機器に該当するプログラム
1) 医療機器で得られたデータ(画像を含む)を加工・処理し、診断又は治療に用いるための指標、画像、グラフ等を作成するプログラム
2) 治療計画・方法の決定を支援するためのプログラム(シミュレーションを含む)
(2) 医薬品医療機器等法において医療機器に該当しないプログラム
1) 医療機器で取得したデータを、診療記録として用いるために転送、保管、表示を行うプログラム
2) データ(画像は除く)を加工・処理するためのプログラム(診断に用いるものを除く)
3) 教育用プログラム
4) 患者説明用プログラム
5) メンテナンス用プログラム
6) 院内業務支援プログラム
7) 健康管理用プログラム
8) 一般医療機器(機能の障害等が生じた場合でも人の生命及び健康に影響を与えるおそれがほとんどないもの)に相当するプログラム(新施行令により、医療機器の範囲から除外されるもの)
以上はあくまでも日本国内の規制ですが、Apple Watchの開発元であるアメリカ合衆国ではFDAの規制があります。では、実際にApple Watch Series 4はどのような認可を受けたのでしょうか?FDAのホームページを検索すると以下の検索結果がヒットしました。
de novoとは、今までの規制にない、あるいは規制の枠組みでくくりきれない新たな装置に対して設けるものです。どうやらApple Watch Series 4では、従来の規制の枠組みには収まりきらなかったため、de novoで承認したようです。では、その中身はどのようなものでしょうか?
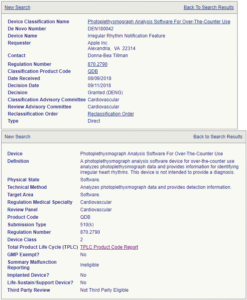
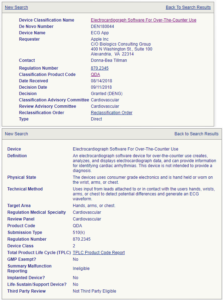
これらの図はそれぞれの承認内容の詳細です。DEN180042のDevice Nameは不整脈検知機能となっており、DeviceはOver-The-Counter Useの脈波解析ソフトとなっています。このOver-The-Counter Useとは病院等で医師又は看護師などによって測定されるものではなく、市販されるもの、という意味です。Physical Stateはソフトウェアとなっています。一方でDEN180044はDevice NameはECGアプリケーションで、DeviceはOver-The-Counter Useの心電計ソフトウェアとなっていますが、Physical Stateは「本装置は消費者グレードの電子機器を用い、ハンドヘルドあるいは手首、腕、または胸に装着する。」となっています。いずれのRegulation Number (870.2791, 870.2345)も現行の規制には記載されていません。どうやらDEN180042は心電図に異常があった際に、それを検知してユーザーあるいは指定された報告先に通知する機能を指しているようです。一方DEN180044はちょっと解釈が難しいです。なぜならDeviceとしてはソフトウェアとうたっていますが、Physical Stateではハードウェアの記述があるからです。いずれにせよ、これが心電計としての機能を持つものであることは間違いなさそうです。ちょっと気になったのは「消費者グレードの電子機器(consumer grade electronics)」という記述です。少なくとも国内の医療機器では製造に当たりトレーサビリティを厳しく設けています。すなわち製造に当たっての原材料に関してはどの業者からどういった規格の材料をいつ、どのように、どれくらい購入したかの記録を付けなくてはなりません。実は医療機器のメーカーにとってはこれが結構大変な作業です。いわゆる民生機器ではそれまで納入していた業者より安く同等品が購入できるのであれば、そちらへ乗り換えることはよくあることですし、報告の義務もありません。ところが医療機器では少なくとも記録をつけることは義務付けられていますし、主要な構成品に関しては報告義務もあります。これは品質の保証の観点からはとても良い制度ではありますが、メーカーにとっての重荷であることは間違いありません。すなわち出口さえしっかりしていればよい、という理論はここでは通用せず、製造過程における部品の品質管理までをも課せられるのが医療機器です。今回のApple Watch Series 4で、もしこの規制が解かれ、出荷時の品質保証だけで医療機器として認められるのであれば、Apple社にとっては大きな(かなり大きな)コスト削減につながるといえます。
FDAですら従来の規制の枠に収まらずDe Novoとして承認しているくらいですから、国内の規制の枠では、この機能が収まるとも思えません。しかしながら、あえてどれが一番近いか考えてみましょう。心電計としてユーザーの状態を記録する機能を持つハンドヘルドデバイスは日本にもあります。三栄メディシス社から発売されているCheckme ECGがそれにあたります。こちらは医療機器登録されている事はもちろん、ソフトウェアも内蔵の機器なので、従来の医療機器の枠組みに入ることになります。この装置の機能はあくまでも記録と転送だけなので、装置自体に脈波の異常を検知する機能は含まれていません。得られた測定結果を解析し診断するのはあくまで医師の仕事です。デバイスの形態としてはApple Watchに極めて近いといえます。但し、Apple Watchはソフトウェア(アプリケーション)をインストールすることによってさまざまな機能を持てますから、形態は時計ですが、汎用のPCとほぼ同じ機能も併せ持っています。したがって、従来の医療機器としてくくられている、それ自体に特定の機能を内包し、その機能以外のことはできないデバイスとはこの点が大きく異なっています。
ではソフトウェアの観点からはどうでしょうか?医療機器に該当しないプログラムの例として健康管理用プログラム、というものがあります。従来のApple Watchに搭載されていた活動量計、心拍計、万歩計などからえられたデータを管理するソフトウェアはこれに当たります。同様のソフトウェアはiPhoneにも搭載されていますので、ユーザーはこのデータをもとに各自の健康管理が可能になります。面白いのは、このソフトウェアには血圧を記録する欄があることです。血圧計自体は医療機器ですが、そこから得られたデータを記録するソフトウェアは医療機器には該当しないと判断されています。心電図も医療機器である心電(図)計から得られたデータを記録するだけでは医療機器としては該当しないように思われますが、「医療機器で得られたデータ(画像を含む)を加工・処理し、診断又は治療に用いるための指標、画像、グラフ等を作成するプログラム」は医療機器に該当して今いますので、本人が心電図を見て楽しむ(?)分には構わないが、これが診断に使われるのであれば医療機器に相当してしまいます。実際素人が心電図を見てもそれが何を意味するのかを判断できませんし、逆に医師に見せた時に医師が判断できないようなグレード(例えばデフォルメされた波形など)では実用にはなりませんので、やはりECGに関しては医療機器とみなすのが妥当だといえます。
パルスオキシメータ
もう一つのウェアラブルデバイスの例を見てみましょう。病院に入院あるいは搬送された経験のある方は指先にパルスオキシメータをつけられたことがあるかと思います。これはヘモグロビンが酸素と結びついたときに吸収する波長が変わることを利用して、患者の血中の酸素飽和度を測定する装置です。救命救急のABCとはAirway, Breathing, Circulationと、すべて組織の末端に酸素を届ける機能を指すくらい、ヒトの体は酸素が必要です。ちゃんと血液が循環している限りにおいては血中の酸素飽和度を見れば、患者さんの組織における呼吸ががどの程度達成できているのかが判り、さらにはこの測定自体が非侵襲であることからも臨床現場では多用されています。パルスオキシメータ自体は医療機器ですが、実は登山の時には高山病の予防・診断にも役立ちます。標高が高くなるにつれて血中酸素飽和度は低下し富士山山頂(3,776m)で平地の3分の2、エベレスト頂上(8,848m)で半分と言われています。ただしこれはその環境に順化した場合であって、急激に登攀した場合はもっと悪くなると考えられています。平地で血中酸素飽和度が90%を割ると酸素吸入の適応となりますので、登山はかなり危険なスポーツともいえます。高山病にならないためにはゆっくりと登攀し体を慣らしていくことが重要で、その際にパルスオキシメータで測定しながら、現在の標高における標準的な酸素飽和度と比較することで、より客観的に判断することが可能となります。この目的でパルスオキシメータを持参する登山家もいるようです。
実はこのパルスオキシメータを内蔵した時計があります。Garminというアメリカのメーカーの時計ですが、日本で販売されている同じ時計では、このパルスオキシメータの機能が削除されています。理由はApple Watch Series 4と同じで、この機能が医療機器としての対象となってしまうからです。しかしながら、このあたりになってくると少しグレーゾーンにかかってくるような気もします。なぜならパルスオキシメータの出力はパーセント(%)で表されるため、心電図のように専門家が見ないと解釈できないような複雑な出力ではなく、心拍数や血圧のように素人でも解釈ができる値だからです。ちなみに心拍数は時計を見ながら指先で測定することで得られるので、心拍数計は医療機器ではないそうです。もしかしたら、既存のパルスオキシメータとの相関性を取るだけで、モバイルのパルスオキシメータは医療機器として認められるのかもしれません。
もし、ご自分たちで開発した機器を医療機器として認可を取りたい、といったご要望がありましたら、AmedTechにぜひご相談ください。きっとお役に立てると思います。
【追記】FDA approvalとFDA Clearance
米国の医療機器を見ますとFDA approvedという表記とFDA Clearedという表記があります。この違いは何でしょうか?FDAにおけるMedical Deviceの承認には510(k)とPMA (Premarket approval)という2つのルートがあります。510(k)とは、すでに市場に出回っている医療機器(FDAの認可を受けていることが前提)とsubstantially equivalentであること、すなわち実質的に同じ機能を有する機器についてFDAの販売認可(distribution approval)を受けることです。またFDAでは医療機器の人に与える影響度の大きさによってクラス分けをしており、ほとんど影響がないクラスⅠから、重大な影響度を持つクラスⅢまで分かれています。またクラスⅠとⅡの中には、510(k)を免除されているものもあります。しかしながらクラスⅢの機器は必ずPMAの申請をしなくてはなりません。またクラスⅠやⅡでも、全く新たな機能を持っていてすでに市場に出回っている機器の中に実質的に同じ機能を有する危機がない場合はPMAの申請が必要です。510(k)で承認された場合はcleared, PMAで承認された場合はapprovedと呼ばれますが、市場における販売に関してはどちらも同じです。
基本的には510(k)かPMAがFDAの承認を受けるルートですが、全く新しいコンセプトの機器が出てきたときにはこの枠では収まらないときがあります。510(k)は既存の機器との同等性を証明すればよいわけですから、申請にかかる手間、費用、時間のいずれもPMAに比較してずっと少なくて済みます。ですので、何とか510(k)で通してもらいたいわけですが、申請をしてもFDAが、すげなく”not substantially equivalent” (NSE) と通告してくることがあります。こうなってきますと、FDAにクラス分けをお願いしなくてはなりません。2012年には新たにNSEを受けることなく、最初からDe Novoの申請をすることが可能になっています。いずれにせよ、De NovoではFDAが申請内容を吟味してクラス分けをするわけですが、この決定を申請後150日以内にしなくてはならないFDAも大変です。Appleの場合は2018年8月14日申請をして、9月11日には返事を出しているので素晴らしい仕事ぶりです。ぜひPMDAにも見習ってもらいたいですが、予算と人員数を考えるときついかもしれませんね。De Novo申請の返事をもらったことで、Appleはこれを商品として販売することが可能となり、さらに後続の同等機能品については510(k)による申請が可能となります。とはいえ、FDAからの通告(DEN180042、DEN180044)を読むと、special controlとして付帯条件があったり、通常の医療機器としての販売後の異常事態(副作用等)の報告義務などもあり、iPhoneやMacを販売していた会社としてはかなり勇気のある決断だったと思います。