皆さんこんにちは。AmedTech代表の天野です。
抗体は体外診断薬によく使われますが、抗体っていったいどのようなものでしょうか?そしてなぜ体外診断薬でよく使われるのでしょうか?今回はそのあたりをご紹介いたします。
抗体とは
抗体とは特異的に標的を認識し結合できるたんぱく質のことです。こんな格好をしています。

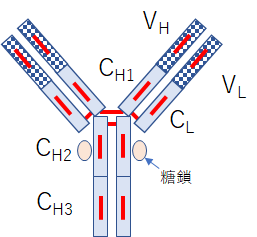
小さなぶつぶつで描かれたものが、結晶構造解析をなされたIgGで、それを模式的に描いたものが次の図です。ここでIgGと言っているのはImmunoglobulin (イムノグロブリン)Gの略です。模式図の中でLとついているものはLight Chain(軽鎖)、HとついているのはHeavy Chain(重鎖)を示すものです。VはVariable Regionの略で、ここで標的を認識します。一方CはConstant Regionの略で、同じタイプのIgではほぼ同じアミノ酸配列を持っています。赤い線はS-S結合を示しています。アミノ酸の中にはチオール基(SH)を持つものがあり、このチオール基2つがS-S結合(disulfide bond:ジスフィルド結合)と呼ばれる共有結合を起こし、アミノ鎖を3次元的に、より強固に結び付けます。ヒトの場合IgはA, D, E, G, Mの5種類に分けられ、さらにIgAはIgA1とIgA2に、IgGはIgG1からIgG4のサブタイプに分かれます。それぞれ異なる機能を持っていますし、免疫活動の異なる場面と時間で活躍します。
抗体の特徴
抗体の特徴は、なんといっても標的に特異的に結合できることです。標的、とは多くの場合たんぱく質ですが、たんぱく質以外にも核酸であったり糖鎖や脂質を認識してしまうことがあります。「してしまう」と書いたのは、自己抗体と言って自分の体内の標的を攻撃してしまう自己免疫疾患という病気があり、DNAを含む核に対する抗体を産生してしまう場合膠原病となり、脂質を攻撃してしまう場合は原発性抗リン脂質抗体症候群という難病指定されている病気になってしまうからです。ちなみに、金属アレルギーは金属に対する過敏反応ではありますが、金属イオンに直接抗体が反応するわけではなく、金属イオンと結合したたんぱく質を認識してます。
このように抗体の標的となる物質を一般に抗原(Antigen)と呼びます。抗原にはたくさんの種類がありますが、どうやって抗体はこれらを認識するのでしょうか?この答えは抗体のVariable Regionにあります。Light Chain (軽鎖)とHeavy Chain(重鎖)の末端にはVariable Regionがあり、この部分のたんぱく質が変性して3次元的に抗原と一番距離が近くなります。「変性」と書きましたが、1つの抗体が変化する、というわけではなく、何万となく生産される抗体の中で、最も抗原と良く結合できるもの、すなわち、抗原との物理的距離が一番近くなるもの、が選択されていくので、結果として抗原に対して最も特異的に結合できる抗体が生まれることになります。この結合の強さの指標としてaffinity(アフィニティー:親和性)とAvidity(アビディティー:結合活性)というものがあります。抗原に対する抗体の結合部位をパラトープ(Paratope)、抗体が反応する抗原の領域をエピトープ(Epitope)と呼びますが、このパラトープとエピトープの結合の強さをアフィニティーと呼びます。一方、抗体は複数の抗原結合部位を持ちますが(IgG, IgE, IgDでは2か所、IgAでは4か所、IgMでは10か所)、抗原分子、抗体分子全体の結合の強さをディティーと呼びます。
抗体の生成
では、この抗体はどうやってできるのでしょうか?抗体は免疫反応の担い手です。免疫とは、外部から侵入してきた異物に対し体が排除しようとする機構を言います。異物は大きなものはとげや細菌といったものから、小さいものは金属イオンのようなものまで、さまざまなものがありますが、そのすべてを排除していては食事すらできませんから、どこかで区切りをつけなくてはいけません。その一つが、自己と非自己です。すなわち自分の体を構成しているものは攻撃をせず、それ以外のものは良くないものとして攻撃をします。様々な栄養分は事故を構成する要素ですから、普通は自己と認識します。ところが、小麦粉アレルギーやそばアレルギーにみられるように、食品に対してすら免疫反応が現れることがあります。もう一つの区切りは大きさです。抗原を認識する抗体はたんぱく質ですから、見分けられる対象に限りがあります。抗体による抗原の認識は、ちょうど両手の人差し指、中指、薬指の6本でリンゴを包み込むようなイメージで、軽鎖と重鎖のそれぞれに3つ程度の領域が抗原(リンゴ)を認識します。この1本の指のリンゴに接触する領域はアミノ酸にして数個程度です。したがって、認識できる抗原の大きさとしては、せいぜいアミノ酸数個の鎖、すなわちペプチド程度までで、それより小さい、アミノ酸単体や、原子イオンのレベルは認識できません。ちなみに、上記のリンゴは、木になっているリンゴでもよいし、バスケットに入っているリンゴでも構いません。すなわち抗原としてはるかに大きなものであったとしても、抗体が認識できる領域はその中のごく一部であるということです。したがって、1種類の抗体(モノクローナル抗体)はリンゴ1個しか認識できなかったとしても、同じ木になっている別のリンゴはほかの抗体が認識することが可能であるため、リンゴの木という抗原に対してはたくさんの抗体(ポリクローナル抗体)がくっつくことができます。
では、どのような過程を得て抗体はできてくるのでしょうか?一般的には体内に取り込まれた抗原は、さらに抗原提示細胞に取り込まれ、この細胞中で分解された後、断片(ペプチド)がMHC(Major Histcompatibility:主要組織適合抗原)分子とともに細胞表面に提示されます。そうしますと、この抗原ペプチドとMHCの複合分子をT細胞と呼ばれるリンパ球が認識し、サイトカインと呼ばれる抗体生成細胞であるB細胞の抗体生成を助けるシグナルを出します。一方B細胞は誕生に当たって、遺伝子の組み換えが起こり、ある特定の抗原を認識可能な抗体を表面に持つことができます。この遺伝子の組み換えこそが数十万、数百万種の様々な抗原を認識できる秘密であり、この秘密を解き明かした利根川進氏はノーベル賞を受賞しました。このB細胞とT細胞からのサイトカインとによって、抗体は生成されます。ところが、これで終わりではありません。小さい子供たちは、まだ幼少のうちにたくさんのワクチンを接種されます。これは、病原体の一部の抗原を体内に導入することによって、免疫機構の活性化を図り、実際に外部から病原体が侵入してきたときに、より素早く、より強力に抗体を産生できるようにするためです。このように、免疫機構は1回目の抗原に対する暴露と、2回目以降の暴露では応答が異なります。1回目の暴露では特異性(アフィニティー)は弱いけれど、アビディティーの高い(5量体と言って、IgGが5個くっついたような形をしていて抗原結合部位を10か所も持っている!)IgMが主役を担いますが、実際にIgMが生産されるまでには時間がかかります。2回目以降では、よりアフィニティーの高いIgGが主役を担い、短時間で、より多量な抗体が生産されます。これは普段は良い方向に働くのですが、悪い方向に働くとアナフィラキシーショックを引き起こします。1回目に蜂に刺されたときは何ともなかったのに、2回目に刺されたときにショック症状を起こしてしまうのは、以上のような機構によるものです。
抗体の利用
体内での抗体はおおよそ以上のような過程を経て生成されますが、これを工業的に使うにはどうしたらよいでしょうか?以前は大型の動物(ヤギや馬など)に抗原(ペプチド)を複数回注射して、血清から抗体を生成していました。現在でも素早く抗体を、ある程度の量収集するには使われている手法です。しかしながら、動物実験に対する批判の高まりや、この手法ではポリクローナル抗体しか採取できないため、この手法はどんどん少なくなってきています。一方で、死なない細胞(がん化した細胞)と抗体産生細胞を融合させたハイブリドーマと呼ばれる細胞を培養し、その培養液から抗体を生成する手法は、より大量の、しかもモノクローナル抗体を採取することが可能であるため、この手法は爆発的に普及しました。このモノクローナル抗体を作製する方法を1975年に発明したジョルジュ・J・F・ケーラーとセーサル・ミルスタインは1984年にノーベル生理学・医学賞を受賞しています。モノクローナル抗体とは1か所のエピトープを認識する単一の抗体です。実際のモノクローナル抗体の生成法は以下の通りです。まず、複数匹のネズミを抗原で複数回刺激します。そののち、血清の抗原に対する反応性をELISAによって確認し、一番反応性の良かったネズミの脾臓からB細胞を採取します。そして、細胞融合の技術を用いてミエローマ細胞と融合させ、ハイブリドーマを作ります。これをHAT培地で培養しますが、この際、96穴プレートなどを使い、培地を分割します。すべての培地の上清をELISAによって検査し、最も反応性の良いウェルを選択します。このウェルの中にある細胞を再度、96穴プレートに蒔きますが、この時には1ウェルに1個以下の細胞となるような濃度で蒔きます。この作業により、細胞の入っていないウェルとは言っているウェルができますが、細胞の入っているウェルには1個の細胞しか入っていないことになります。細胞が分割し、コロニーを形成するころに、再度ELISAによってセレクションをかけます。この結果、抗原に対し最も反応性に良いウェルには単一細胞のクローンがいることになりますから、その細胞の産生する単一抗体、すなわちモノクローナル抗体が取れることになります。
このように、かなり人工的にモノクローナル抗体は製造することが可能となりましたが、やはり最初の抗体生産細胞はマウスの中でしか作れません。最近はそれすら人工的にデザインしようとする技術が出てきていますが、まだまだ工業的に普及はされていません。もっとも一度目的とする抗体を生産するハイブリドーマ入手できれば、あとは興行的にモノクローナル抗体は製造できますから、このハイブリドーマを作る(選択する)技術はこれからもどんどん進歩してくと思われます。
実は抗原の検出には、単にアフィニティーの良い抗体があればよい、というわけではありません。抗原と抗体が結合していることを何らかの方法で検出しなくてはならないからです。もっとも直接的な手法は、抗体を標識をしておき、抗原を個体の上に固定し、これらを混ぜあわせ、しばらく反応させたのちに、余分な抗体を洗い流し、どれだけ抗体が残ったかで評価する方法です。抗体を酵素で標識しておいて、この酵素による呈色反応を見る手法がELISA(Enzyme Linked Immuno-Solvent Assay)です。実は、この抗体の標識が曲者です。最も一般的な標識方法は架橋剤などを使って抗体と酵素を結合させる方法ですが、この作業の最中に抗体が変性してしまい、アフィニティーが落ちてしまうことがあります。また、二次抗体を使い、一次抗体の重鎖を認識させ、酵素自体は二次抗体につけておく方法もありますが、二次抗体のアフィニティーやアビディティーにより、必ずしも期待した効果が得られないことがあります。ちなみにアフィニティーと特異性は異なります。アフィニティーが良くても特異性が低くほかのたんぱく質とクロスリアクトすることもありますし、逆にアフィニティーが低く洗浄条件を上げるとすぐにはがれてしまうが、ほかのたんぱく質とは全く反応しない、なんていう抗体もあります。
駆け足で抗体について書いてみましたが、要するに抗体は生ものと思ってよいと思います。選択をかけて、最も目的に合致したものを選ぶことは大切ですが、最終的には実装してみて、その効果のほどを確かめてみないとなんとも予想が付きません。特に体外診断薬などの製品にする際には、保存性能や劣化の具合など、実験室ではなかなかわからない特性にも気を使わなくてはなりません。冷蔵保存は必須ですが、凍ってしまうと急激に分解が進んでしまいます。冷蔵庫での保存でも、冷機の吹き出し口の近くでは知らず知らずのうちに抗体のチューブが凍っていた、などということもあります。製品化に向けた魔の川、死の谷は確実に存在します。AMedTechが皆様のお役に立てれば、これほどうれしいことはありません。